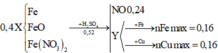
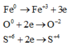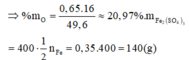Hoà tan hoàn toàn 49,6 gam hh X gồm Fe, FeO, Fe 2 O 3 và Fe 3 O 4 bằng H 2 SO 4 đặc, nóng thu được dung dịch Y và 8,96 lít khí SO 2 (đktc). Thành phần phần trăm về khối lượng của oxi trong hỗn hợp X và khối lượng muối trong dung dịch Y lần lượt là:
A. 20,97% và 140 gam
B. 37,50% và 140 gam
C. 20,97% và 180 gam
D. 37,50% và 120 gam